


Aufgaben zum Atomaufbau
Wichtige Schritte in der historischen Entwicklung der Atommodelle:
 |
Demokrit etwa 460-371 vor Christus Demokrit war nicht der erste der alten Griechen, seine Vorstellungen gehen auf seinen Lehrer Leukipp zurück. Leukipp sagte als erster, dass die Stoffe aus kleinsten Teilchen bestehen. Demokrit sagte, dass sich die Atome im leeren Raum frei bewegen können, zusammenstoßen, sich vereinigen und wieder trennen. Er sagte, es gibt nur die Atome und den leeren Raum. Animation als VRML-Datei öffnen. |
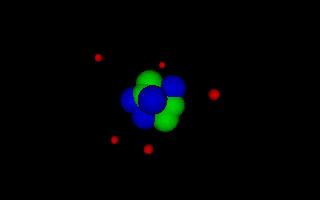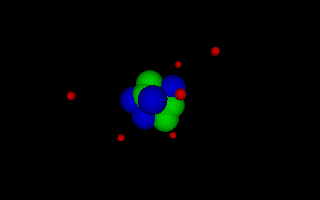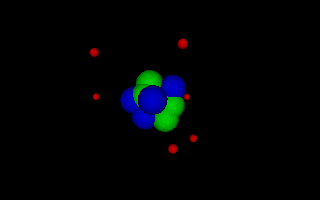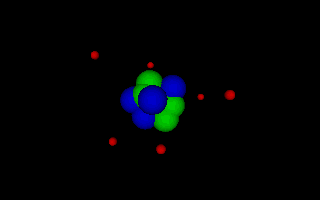 |
Lord Ernest Rutherford 1871-1937 Rutherford erkannte durch seine Streuversuche als erster, dass das Atom bis auf den sehr kleinen Kern leer ist und seine Größe nur durch die am Kern gehaltenen Elektronen bedingt ist, die um den Kern kreisen wie Planeten um die Sonne, da die Coulombkraft als Zentripetalkraft wirkt. Animation als VRML-Datei öffnen. |
 |
Niels Bohr 1913-1963 Bohr entwickelte das rutherforsche Atommodell weiter, indem er nur noch solche Kreisbahnen zuließ, deren Umfang ein Vielfaches der de Broglie Wellenlänge beträgt. Damit konnte er die Energiesprünge erklären, die beim Absorbieren und Emittieren von Licht (im erweiterten Sinn) durch die von Balmer, Lyman und andere gefunden wurden. Animation als VRML-Datei öffnen. |
Die folgenden Bilder demonstrieren den Aufbau der Atome von unterschiedlichen
Stoffen nach dem Atommodell des N. Bohr:


Alle Angaben
zum Ausfüllen der Tabelle findest du an gegebener Stelle im deinem Tafelwerk (PSE)
oder online auf http://www.experimentalchemie.de/02-periodensystem.htm.
|
|
Mangan | Gold | Brom |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|




|
|
Ba+ | Ne- | Ni2+ | Zn.. | Fe3+ | O.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
|
|
|
Isotope sind die zu einem Element gehörenden Atome mit gleicher Protonenzahl, aber unterschiedlichen Massenzahlen. Die Ordnungszahl entspricht der Anzahl der Protonen im Kern und die Massenzahl der Summe aus Protonen und Neutronen im Kern. Dies bedeutet also, dass Isotope ein und desselben Elements nur eine verschiedene Anzahl von Neutronen in ihren Kernen haben. In der Natur treten Isotope in nahezu konstanten Mischungsverhältnissen auf und verursachen so die nicht ganzzahligen Atomgewichte der chemischen Elemente. Zum Beispiel hat Chlor die relative Atommasse 35, 457. Das kommt daher, dass Chlor aus Isotopen besteht. Chlor 35 tritt mit einer Häufigkeit von 76%, Chlor 37 mit 24% auf. So kommt man auf die Zahl 35,457. Das ist die relative Atommasse.
|
|
Mn | U | ||||||
|
25
|
||||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|