|
Kapitel 2: Leiter und Isolatoren Noch einmal zur Erinnerung: Stoffe, die den el. Strom gut leiten, heißen Leiter. Demgegenüber stehen die Isolatoren - also die Stoffe, die den el. Strom nicht leiten, sondern isolieren. Aber weshalb leiten die Leiter den el. Strom und Isolatoren nicht??? |
|
|
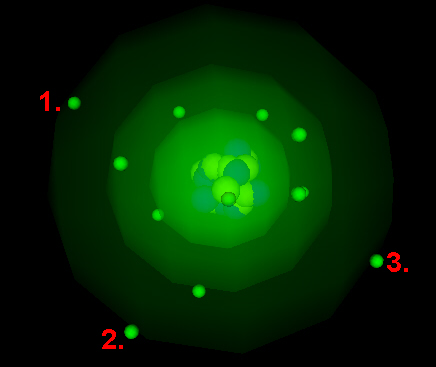
Aufbau eines typischen Isolators Beispiel: Kohlenstoff
Animation als
DivX-Video |
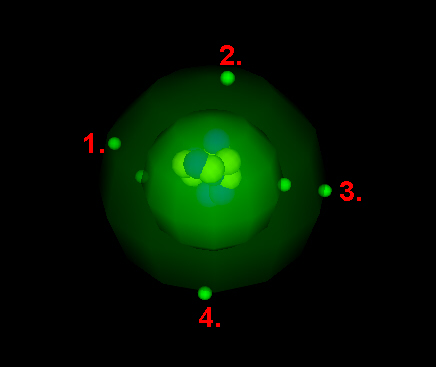
Aufbau eines typischen Leiters Beispiel: Aluminium
Animation als
DivX-Video |
|
Das Aluminiumatom ...
... hat 16 Protonen (+) und 16 Elektronen (-). Die Protonen sind fest im Atomkern gebunden und stehen nicht für die el. Leitung zur Verfügung. Die Elektronen bewegen sich auf verschiedenen "Schalen" um den Atomkern. Die Außenschale enthält 3 Außenelektronen (im Bild markiert)! Diese Außenelektronen sind nur sehr schwach gebunden - also im Prinzip "frei". Das Kohlenstoffatom ...
... hat 6 Protonen (+) und 6 Elektronen (-). Die Protonen sind ebenfalls fest im Atomkern gebunden und stehen somit nicht für die el. Leitung zur Verfügung. Die Elektronen bewegen sich auf nur zwei "Schalen" um den Atomkern. Die Außenschale enthält 4 Außenelektronen (im Bild markiert)! An dieser Stelle kommt die Bindung der Atome ins Spiel; wenn man nicht nur ein Atom betrachtet, sondern eine Menge gleicher Atome in einem Stoff, dann versuchen diese sich mit den Nachbaratomen zu verbinden. Dabei entstehen gewöhnlich stabile - also komplett gefüllte - Außenschalen. Wenn zum Beispiel ein Kohlenstoffatom mit seinen vier Nachbarn eine solche Bindung - Atombindung - eingeht, dann sind alle vier Außenelektronen mit ihren Nachbaraußenelektronen als Elektronenpaare wieder fest in einer Bindung verankert. Sie stehen also nicht für die el. Leitung zur Verfügung. Wir haben einen Isolator!!! Anders sieht das beim Aluminiumatom aus: Hier bleiben immer Außenelektronen übrig, auch wenn die Bindung - Metallbindung - stattgefunden hat. Diese übrig gebliebenen Elektronen befinden sich praktisch ohne Bindung zwischen den Aluminiumatomen (die man jetzt als Metall-Ionen bezeichnet, weil ihnen ein Elektron fehlt) und stehen somit für die elektrische Leitung zur Verfügung! |
|